信陽優質紗布塊、紗布墊、口罩、手術包、造影包、換藥包、產包、防護服、手術衣、中單、導尿包、棉球、棉簽、防護口罩、碘仿紗布/濕巾、凡士林(紗布)、手套、麻醉包、輸液貼、會陰包價格
發布時間:2022-03-17 00:43:27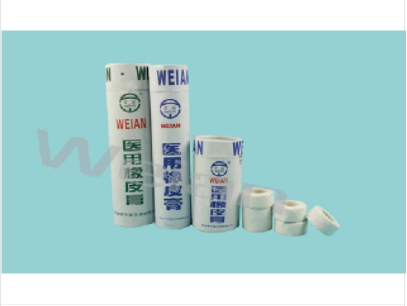
信陽優質紗布塊、紗布墊、口罩、手術包、造影包、換藥包、產包、防護服、手術衣、中單、導尿包、棉球、棉簽、防護口罩、碘仿紗布/濕巾、凡士林(紗布)、手套、麻醉包、輸液貼、會陰包價格
將涉及口罩原料要求、結構要求、標簽標識要求、外觀要求等,主要指標包括功能性指標顆粒物過濾效率、呼氣吸氣阻力指標、密合性指標等。作為紡織品,指標還涉及甲醛含量、pH值、微生物如大腸桿菌菌群數量、真菌菌落總數等。另外,新國標還將對口罩進行分級、分類。根據大氣污染程度,分為重度污染適用、中度污染適用、輕度污染適用;針對不同人群,如成人、兒童、體弱者的特征,設定不同的呼氣阻力指標對口罩進行分類。

信陽優質紗布塊、紗布墊、口罩、手術包、造影包、換藥包、產包、防護服、手術衣、中單、導尿包、棉球、棉簽、防護口罩、碘仿紗布/濕巾、凡士林(紗布)、手套、麻醉包、輸液貼、會陰包價格
作為一個科技密度大、研發難度高的行業,醫療器械行業的發展與政策息息相關。自2014以來,政策對于醫療器械行業的扶持力度日益加大,這也推動者本土醫療器械市場朝著更加健康的方向迅速發展。2014年2月,食品藥品監督管理總局發布的《創新醫療器械特別審批程序(試行方案)》,其中針對創新醫療器械設置的審批通道,讓新產品的審批變得更為高效科學。同年5月份,衛生計生委規劃司聯手中國醫學裝備協會,共同啟動了對本土醫療設備產品的評選,這個創新性的活動不僅能夠促進整個醫療器械行業的轉型與升級,促進醫療成本的降低,還能推動整個行業繼續發展。 2015年5月份,《中國制造2015》將醫療器械行業作為整個中國工業的重心,提出要全面提高整個醫療器械行業的創新研發能力與科技實力,進一步提高行業的規模化水平與產業化水平,將醫用機器人與影像設備等新興高端領域,繼續推動全降解血管支架以及遠程診療等高值醫療產品的發展,讓整個行業邁入健康發展的快車道。近些年來,醫療器械行業的化已經成為了不可逆轉的趨勢,想要在整個行業占據優勢,不僅要依靠實力占據本土市場,還要率先出擊,在市場尋求自己的地位。政策的支持,讓本土醫療器械市場持續升溫,也讓本土企業邁向了自主研發、自主生產的創新型道路。未來的幾年間,有了強有力的政策支撐,本土醫療器械市場的發展之路會變得更為光明。
信陽優質紗布塊、紗布墊、口罩、手術包、造影包、換藥包、產包、防護服、手術衣、中單、導尿包、棉球、棉簽、防護口罩、碘仿紗布/濕巾、凡士林(紗布)、手套、麻醉包、輸液貼、會陰包價格
“一些國外知名品牌的CT機其實是東軟代工生產的。”在東軟展臺前,一位工作人員介紹說。事實上,20年來,正因為有東軟這樣一批本土企業,曾經充斥國內醫療市場,危害國民安全的二手CT再也不見蹤影,引發進口CT價格平均降幅20%至30%。目前,我國CT等高科技醫療設備的研制和生產步入世界先進行列,中國成為世界第四大CT整機生產國和出口國。

信陽優質紗布塊、紗布墊、口罩、手術包、造影包、換藥包、產包、防護服、手術衣、中單、導尿包、棉球、棉簽、防護口罩、碘仿紗布/濕巾、凡士林(紗布)、手套、麻醉包、輸液貼、會陰包價格
科技部于2011年11月公布了《醫療設備科技產業“十二五”專項規劃(2011-2015)》,目前對醫療設備產業的發展有著積極的推動作用。該規劃總目標是,到2015年,初步建立醫療設備研發創新鏈,醫療設備產業技術創新能力顯著提升;突破一批共性關鍵技術和核心部件,開發一批具有自主知識產權的、高性能、高品質、低成本和主要依賴進口的基本醫療設備產品,滿足我國基層醫療衛生體系建設需要和臨床常規診療需求;進一步完善科技創新和產業發展的政策環境,培育一批創新品牌,大幅提高產業競爭力,醫療設備科技產業發展實現快速跨越。

信陽優質紗布塊、紗布墊、口罩、手術包、造影包、換藥包、產包、防護服、手術衣、中單、導尿包、棉球、棉簽、防護口罩、碘仿紗布/濕巾、凡士林(紗布)、手套、麻醉包、輸液貼、會陰包價格
2014年7月30日總局簽發《醫療器械經營監督管理辦法》(總局令第8號,以下簡稱“新辦法”),將于2014年10月1日實施,《醫療器械經營企業許可證管理辦法》(原局令第15號,以下簡稱“原辦法”)同時廢止。相較之下,有如下重大政策變化:1.原辦法共七章四十二條,新辦法共六章六十六條,結構內容均有重大調整。2.新辦法第四條提出“按照醫療器械風險程度,醫療器械經營實施分類管理”3.新辦法明確:經營一類不需要許可或備案,經營二類實行備案管理,經營三類實行許可管理。4.新辦法第七條指出“全部委托其他醫療器械經營企業貯存的可以不設立庫房”。5.新辦法明確要求第三類醫療器械經營企業還應當具有符合醫療器械經營質量管理要求的計算機信息管理系統。6.新辦法要求從事第三類醫療器械經營的,提出申請,所遞交資料中包括“營業執照和組織機構代碼證”(僅有“名稱預先核準通知書”的將不再具備申請資格);增加了提供法定代表人、企業負責人資質材料的要求;增加了關于計算機信息管理系統基本情況介紹和功能說明。7.新辦法二類備案資料除去不需提供“計算機信息管理系統基本情況介紹和功能說明”,其他資料要求與三類經營一致。備案之日起3個月內現場審核。8.新辦法規定《許可證》和備案憑證中登載信息已不包含舊辦法中的“質量管理人”,新增“經營方式”項目。9.新辦法相較于舊辦法明確了“跨行政區域設置庫房”的要求,明確“應當向庫房所在地”藥監部門備案。10.新辦法增加“新設立獨立經營場所的,應當單獨申請醫療器械經營許可或備案”的要求。11.新辦法相較舊辦法,明確了醫療器械注冊人、備案人和生產企業在其住所或生產地址銷售的,不需辦理許可或備案;在其他場所貯存并現貨銷售的,應當辦理許可或備案。12.新辦法要求許可證有效期屆滿6個月前,申請延續。13.新辦法第三章第三十一條增加了對于“醫療器械銷售人員銷售醫療器械”的要求,需要有“授權書”。14.新辦法相較舊辦法,增加了對于進貨查驗和銷售記錄保存時限的要求。15.新增加醫療器械經營企業委托其他單位運輸醫療器械的,應當對承運方運輸醫療器械的質量保障能力進行考核評估的要求。16.新辦法要求三類企業建立“質量管理自查制度”并按規定上報。17.新辦法對于“第三類醫療器械經營企業自行停業一年以上,重新經營時”應當向藥監部門報告,經核查符合要求后方可恢復經營的要求。規避舊辦法“取證以來未經營無記錄”無據可查的監管尷尬局面。18.明確“加強現場檢查”情形。其中新開辦三類經營企業在加強現場檢查之列。19.新辦法區分醫療器械“批發和零售”。20.新辦法刪除“不需申請許可證二類器械”的規定,亦未規定“不需備案的二類器械”,即所有二類器械經營必須備案。